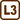Dwa połączone zbiorniki z gazem
Kod zadania: 1075
Zbiornik A zawiera gaz doskonały o temperaturze 300 K i ciśnieniu 5,0·105 Pa i jest połączony wąską rurką ze zbiornikiem B. Zbiornik B ma czterokrotnie większą objętość, zawiera ten sam gaz w temperaturze 400 K i pod ciśnieniem 1,0·105 Pa. Jakie będzie ciśnienie końcowe w układzie, jeśli otworzymy kurek na rurce łączącej naczynia, a w obu zbiornikach utrzymywać będziemy wyjściową temperaturę?
Podpowiedź
Przy pomocy równania stanu gazu doskonałego możemy określić ilość gazu w obu naczyniach.
Po połączeniu naczyń część gazu przepłynie z naczynia A do naczynia B tak, aby w obu częściach panowało to samo ciśnienie. Ciśnienie w każdym naczyniu można określić z równania stanu. Trzeba też pamiętać, że ogólna ilość gazu w naczyniach przed i po otwarciu kurka musi być jednakowa.
Zapis danych
TA = 300 K temperatura w zbiorniku A pA = 5,0·105 Pa ciśnienie gazu w zbiorniku A VB = 4VA związek między objętościami obu zbiorników TB = 400 K temperatura zbiornika B pB = 1,0·105 Pa ciśnienie gazu w zbiorniku B p = ? końcowe ciśnienie gazu Analiza
Na początku z równania stanu gazu doskonałego określimy ilości gazu w obu zbiornikach przed otwarciem kurka.
Po otwarciu kurka gaz rozdzieli się tak, by w obu zbiornikach panowało to samo ciśnienie. Nadal jednak w każdym zbiorniku spełnione będzie równanie stanu, z którego uzyskamy ilości gazu w każdym zbiorniku również po otwarciu kurka.
Ponieważ gaz nie wydostawał się na zewnątrz, jego całkowita ilość w obu zbiornikach przed i po otwarciu kurka będzie taka sama. Stąd też określimy szukaną wartość ciśnienia.
Rozwiązanie
Dla gazu w zbiorniku A zapiszemy równanie stanu w postaci:
\[ p_AV_A\,=\,n_ART_A \]gdzie nA oznacza nieznaną liczbę moli gazu w zbiorniku A, którą z tego równania wyznaczymy:
\[ n_A\,=\,\frac{p_AV_A}{RT_A} \]Podobnie wyznaczymy liczbę moli gazu w zbiorniku B:
\[ p_BV_B\,=\,n_BRT_B\hspace{15px}\Rightarrow\hspace{15px}n_B\,=\,\frac{p_BV_B}{RT_B}\,=\,\frac{4p_BV_A}{RT_B} \]Liczbę moli gazu w zbiorniku A po otwarciu kurka oznaczymy n1, a w zbiorniku B n2. Obie wartości określimy z równania stanu, zapisując też tę samą wartość ciśnienia końcowego p dla obu zbiorników.
\[ pV_A\,=\,n_1RT_A\,\hspace{15px}\Rightarrow\hspace{15px}n_1\,=\,\frac{pV_A}{RT_A} \] \[ p4V_A\,=\,n_2RT_B\,\hspace{15px}\Rightarrow\hspace{15px}n_2\,=\,\frac{4pV_A}{RT_B} \]Całkowita liczba moli gazu w obu zbiornikach przed i po otwarciu kurka jest taka sama, musi więc zachodzić:
\[n_A\,+\,n_B\,=\,n_1\,+\,n_2\] \[ \frac{p_AV_A}{RT_A}\,+\,\frac{4p_BV_A}{RT_B}\,=\,\frac{pV_A}{RT_A}\,+\,\frac{4pV_A}{RT_B} \]Ostatnie równanie przekształcimy i obliczymy szukaną wartość ciśnienia p:
\[ \frac{V_A}{R}\left(\frac{p_A}{T_A}\,+\,\frac{4p_B}{T_B}\right)\,=\,\frac{pV_A}{R}\left(\frac{1}{T_A}\,+\,\frac{4}{T_B}\right) \] \[ p\,=\,\frac{p_AT_B+4p_BT_A}{T_AT_B}\frac{T_AT_B}{T_B+4T_A}\,=\,\frac{p_AT_B+4p_BT_A}{T_B+4T_A} \]Podstawiając dane liczbowe:
\[ p\,=\,\frac{5{\cdot} 10^5{\cdot} 400\,+\,4{\cdot} 1\cdot 10^5{\cdot} 300}{400\,+\,4{\cdot} 300}\,\mathrm{Pa}\,\dot{=}\,2{,}0{\cdot} 10^5\,\mathrm{Pa} \]Odpowiedź
Po otwarciu kurka ciśnienie gazu w obu zbiornikach wyniesie 2,0·105 Pa.